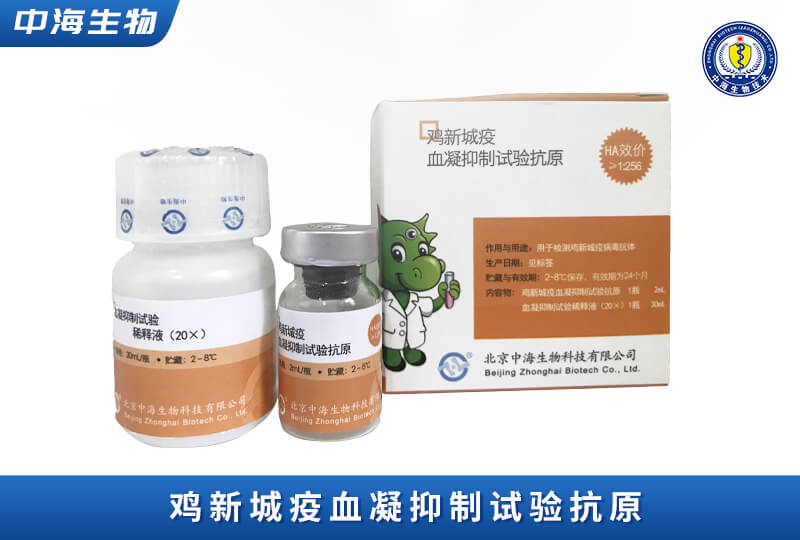
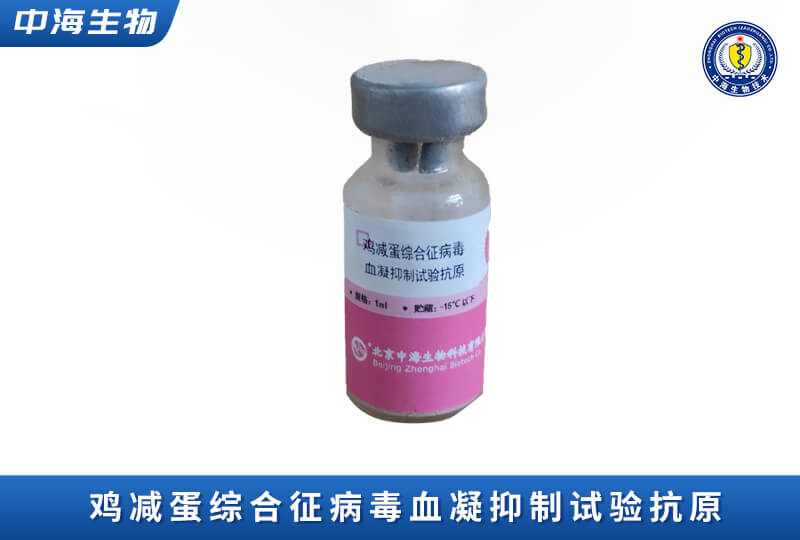
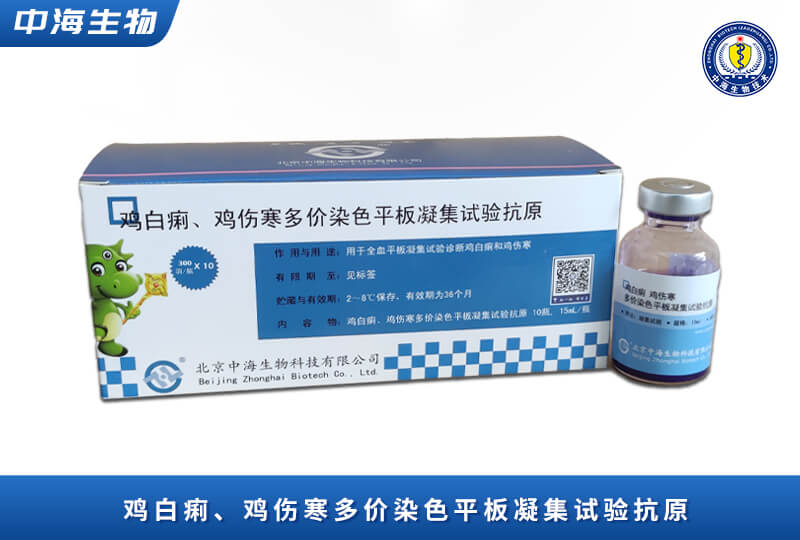
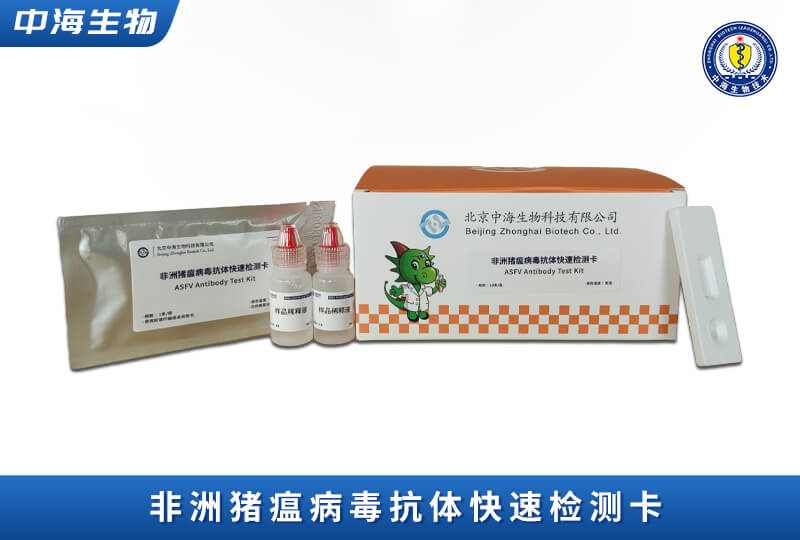
產(chǎn)品服務
product & service
關(guān)于中海
about zhonghai
 中海生物技術(shù)(棗莊)有限公司(以下簡稱“中海生物技術(shù)”)由北京中海生物科技有限公司(以下簡稱“中海生物”)、山東棗莊經(jīng)濟開發(fā)區(qū)共同投資設立,落戶于魯南大健康產(chǎn)業(yè)園區(qū),占地面積10000平方米,預計投資1億元。是專業(yè)從事培養(yǎng)基和診斷試劑產(chǎn)品研發(fā)、生產(chǎn)、銷售于一體的高新技術(shù)企業(yè)。中海生物技術(shù)是實現(xiàn)對微生物培養(yǎng)基和獸用診斷試劑產(chǎn)品全面升級改造的重要平臺,依托中海生物多年積累的技術(shù)優(yōu)勢及產(chǎn)品優(yōu)勢,已建立起無菌檢驗培養(yǎng)基、支原體檢驗培養(yǎng)基、疫苗生產(chǎn)類培養(yǎng)基、即用型培養(yǎng)基、...
中海生物技術(shù)(棗莊)有限公司(以下簡稱“中海生物技術(shù)”)由北京中海生物科技有限公司(以下簡稱“中海生物”)、山東棗莊經(jīng)濟開發(fā)區(qū)共同投資設立,落戶于魯南大健康產(chǎn)業(yè)園區(qū),占地面積10000平方米,預計投資1億元。是專業(yè)從事培養(yǎng)基和診斷試劑產(chǎn)品研發(fā)、生產(chǎn)、銷售于一體的高新技術(shù)企業(yè)。中海生物技術(shù)是實現(xiàn)對微生物培養(yǎng)基和獸用診斷試劑產(chǎn)品全面升級改造的重要平臺,依托中海生物多年積累的技術(shù)優(yōu)勢及產(chǎn)品優(yōu)勢,已建立起無菌檢驗培養(yǎng)基、支原體檢驗培養(yǎng)基、疫苗生產(chǎn)類培養(yǎng)基、即用型培養(yǎng)基、...
新聞資訊
NEWS
-
072024-03
胰酪大豆胨液體培養(yǎng)基使用說明
胰酪大豆胨液體培養(yǎng)基胰酪大豆胨液體培養(yǎng)基使用說明書英文名稱:TrypticSoytoneAgar產(chǎn)品貨號:101019產(chǎn)品規(guī)格:250...
-
072024-03
無菌檢驗常用培養(yǎng)基
1.硫乙醇酸鹽流體培養(yǎng)基胰酪胨15.0g、酵母浸出粉5.0g、葡萄糖/無水葡萄糖5.5g/5.0g、氯化鈉2.5g、L-胱氨酸0.5g...
-
062024-03
培養(yǎng)基污染原因
(1)滅菌方式不正確,導致滅菌不徹底(2)滅菌鍋的滅菌效力不達標(3)滅菌量過多,滅菌前未加熱溶解(4)培養(yǎng)基本身含耐熱菌較多(5)滅...
-
062024-03
培養(yǎng)基產(chǎn)生沉淀
(1)某些培養(yǎng)基原本就含有不溶性沉淀,如TTB,MC培養(yǎng)基等,配方中含有大量不溶性碳酸鈣。(2)滅菌前未充分溶解,如Fraser培養(yǎng)基...
-
062024-03
培養(yǎng)基不凝固或凝固性差
(1)稱量錯誤(2)瓊脂分布不均勻(3)培養(yǎng)基pH不正確(4)加熱過度(5)瓊脂量不足
-
062024-03
培養(yǎng)基顏色不正確
(1)含有酸堿指示劑的培養(yǎng)基,若顏色不正確,通常是由于pH不正確導致的,加熱過度、錯誤的滅菌方式等都會導致此項問題。(2)加熱過度導致...
-
062024-03
大型滅菌器在滅菌的時候總會出現(xiàn)個別瓶子破裂的現(xiàn)象,請問什么原因?是溫度過高,壓力過大,還是內(nèi)部冷熱不均造成的呢?
高壓滅菌造成玻璃瓶的破裂,特別是大型滅菌裝置,最主要還是在放氣冷卻時造成的。究其原因,應該是在放氣時,由于容積較大,壓力在不同位置(內(nèi)...
-
062024-03
兩次培養(yǎng)基用的配方都一樣,為什么一個凝固的特好,一個就凝固不了?
培養(yǎng)基的凝固與否有下列幾種情況決定:1、瓊脂批次有變,沒有做批次試驗,沿用以前的用量造成不足。2、大量元素重復加入,或大量元素母液配制...
-
012024-03
tsa培養(yǎng)基全稱
tsa培養(yǎng)基又稱為胰酪大豆胨瓊脂培養(yǎng)基,是一種基本的非選擇性培養(yǎng)基,含有胰酪蛋白胨、大豆胨、氯化鈉和瓊脂成分,主要用作無菌檢驗及一般微...
-
012024-03
基本培養(yǎng)基和完全培養(yǎng)基的區(qū)別
基本培養(yǎng)基;僅能滿足微生物野生型菌株生長需要的培養(yǎng)基,成為基本培養(yǎng)基。完全培養(yǎng)基;凡可滿足一切營養(yǎng)缺陷型菌株營養(yǎng)需要的天然或者半天然培...
-
272024-02
酵母菌形態(tài)詳解
酵母菌是單細胞真菌,可在缺氧環(huán)境中生存,是人類直接食用量最大的一種微生物。酵母菌的形態(tài)多樣,通常包括球形、卵圓形、臘腸形、橢圓形、檸檬...
-
262024-02
麥康凱液體培養(yǎng)基原理及使用方法-中海生物
麥康凱液體培養(yǎng)基是一種專門用于大腸埃希菌選擇性增菌培養(yǎng)的培養(yǎng)基。其原理及使用方法如下:原理:麥康凱液體培養(yǎng)基中含有明膠胰酶水解物、乳糖...
-
262024-02
麥康凱和ss平板的區(qū)別
麥康凱平板和SS平板在多個方面存在明顯的區(qū)別:成分組成:麥康凱培養(yǎng)基含有鹽類、糖類、氨基酸、維生素和谷胱甘肽等成分,而SS培養(yǎng)基則富含...
-
262024-02
ss平板的原理
SS平板是一種強選擇性培養(yǎng)基,其原理主要基于以下幾個方面:營養(yǎng)成分:SS平板含有必要的營養(yǎng)成分,如蛋白胨、牛肉膏等氮、碳源,這些成分提...
-
222024-02
r2a瓊脂培養(yǎng)基是什么-中海生物
在微生物培養(yǎng)基的使用過程中,平板計數(shù)瓊脂(PCA)是大家熟知的用測定菌落總數(shù)的計數(shù)培養(yǎng)基,其營養(yǎng)含量高,歷史上應用最廣泛。但是對于飲用...
-
222024-02
平板計數(shù)瓊脂使用方法
稱取平板計數(shù)瓊脂培養(yǎng)基23.5g,加入1L純化水或注射用水中,加熱煮沸至完全溶解后分裝,然后經(jīng)116℃高壓滅菌30分鐘。
-
072024-03
兩會 | 沈建忠委員:進一步加強高等級生物安全實驗室建設
“高級生物安全實驗室對于重大動物疫病、人獸共患病、人類重大傳染病防控,以及生物醫(yī)藥研發(fā)、海關(guān)檢驗檢疫、生態(tài)環(huán)境保護等領(lǐng)域起...
-
072024-03
地方媒體發(fā)布獸藥廣告的審批流程圖
證明事項告知承諾書(在地方媒體發(fā)布獸藥廣告的審批)一、吉林省畜牧業(yè)管理局告知內(nèi)容(一)“在地方媒體發(fā)布獸藥廣告審批&rdq...
-
262024-02
農(nóng)業(yè)農(nóng)村部公告 第757號
根據(jù)《獸藥管理條例》、《獸藥注冊辦法》和《獸藥注冊評審工作程序》(農(nóng)業(yè)農(nóng)村部公告第392號)規(guī)定,華南農(nóng)業(yè)大學等2家公司研制的重組禽流...
-
092024-01
中華人民共和國農(nóng)業(yè)農(nóng)村部公告第747號
根據(jù)《獸藥管理條例》、《獸藥注冊辦法》和《獸藥注冊評審工作程序》(農(nóng)業(yè)農(nóng)村部公告第392號)規(guī)定,長春西諾生物科技有限公司等3家公司研...
-
082024-01
培養(yǎng)基的分類及用途有哪些
培養(yǎng)基,對于微生物學家和生物學家而言,是不可或缺的重要工具。它為微生物提供了一個適宜的生長環(huán)境,使這些微小的生命體得以繁榮。培養(yǎng)基不僅...
-
022024-01
中華人民共和國農(nóng)業(yè)農(nóng)村部公告 第743號
根據(jù)《獸藥管理條例》和《獸藥注冊辦法》規(guī)定,經(jīng)審查,批準湖北龍翔藥業(yè)科技股份有限公司等22家單位申報的二氯苯醚菊酯等7種獸藥產(chǎn)品為新獸...
-
022024-01
中華人民共和國農(nóng)業(yè)農(nóng)村部公告 第736號
為保障農(nóng)產(chǎn)品質(zhì)量安全、人畜安全和生態(tài)環(huán)境安全,根據(jù)《中共中央、國務院關(guān)于深化改革加強食品安全工作的意見》,決定對氧樂果、克百威、滅多威...
-
022024-01
中華人民共和國農(nóng)業(yè)農(nóng)村部公告 第735號
根據(jù)《獸藥管理條例》和《獸藥注冊辦法》規(guī)定,經(jīng)審查,批準法國詩華動物保健公司生產(chǎn)的鹽酸頭孢噻呋注射液在我國注冊,核發(fā)《進口獸藥注冊證書...
-
292023-12
農(nóng)業(yè)農(nóng)村部公告 第735號
根據(jù)《獸藥管理條例》和《獸藥注冊辦法》規(guī)定,經(jīng)審查,批準法國詩華動物保健公司生產(chǎn)的鹽酸頭孢噻呋注射液在我國注冊,核發(fā)《進口獸藥注冊證書...
-
262023-12
中國獸醫(yī)藥品監(jiān)察所發(fā)布《寵物臨床急需使用的人用藥品目錄(61種)》
為推動解決當前我國寵物用藥短缺難題,滿足寵物臨床實際用藥需求,在學習貫徹習近平新時代中國特色社會主義思想主題教育期間,我所(中心)開展...
-
182023-12
中華人民共和國農(nóng)業(yè)農(nóng)村部公告 第734號
-
182023-12
中華人民共和國農(nóng)業(yè)農(nóng)村部公告 第733號
-
062023-12
中美歐藥典關(guān)于含量均勻度的不同
以下為正文:藥物制劑的各劑量單位中,活性藥物成分的含量可能因制劑生產(chǎn)中的多種原因,如顆粒的流動性及均勻性較差、生產(chǎn)設備的性能未達到要求...
-
062023-12
抗生素殘留量檢測方法公示(附全文)
國家藥典委最新發(fā)布,全文如下:
-
052023-12
農(nóng)業(yè)農(nóng)村部獸藥評審中心關(guān)于再次公開征求《禽(雞)抗蠕蟲藥臨床有效性指導原則(征求意見稿)》等意見的通知
為規(guī)范獸藥研究工作,統(tǒng)一評審評價尺度,促進獸藥行業(yè)高質(zhì)量發(fā)展,農(nóng)業(yè)農(nóng)村部獸藥評審中心依據(jù)國內(nèi)獸藥行業(yè)的生產(chǎn)研發(fā)及技術(shù)水平實際情況,...
-
212023-11
中美藥典細菌內(nèi)毒素檢查法指導原則異同
《中華人民共和國藥典》(2020年版)(簡稱“《中國藥典》”)收載了9251細菌內(nèi)毒素檢查法應用指導原則。同年...
-
222024-02
平板計數(shù)瓊脂-中海生物
平板計數(shù)瓊脂培養(yǎng)基又簡稱為PCA,是用于菌落總數(shù)的測定,該培養(yǎng)基屬于非選擇性固體培養(yǎng)基,其主要成分包括胰蛋白胨、酵母浸粉、葡萄糖以及瓊...
-
312024-01
關(guān)于2024年春節(jié)放假通知-中海生物技術(shù)
根據(jù)國務院有關(guān)國慶節(jié)放假安排,經(jīng)公司領(lǐng)導同意,現(xiàn)將公司2024年春節(jié)放假安排、相關(guān)要求通知如下:1、春節(jié)放假時間為∶2月10日-2月1...
-
022024-01
國內(nèi)比較好的培養(yǎng)基生產(chǎn)廠家推薦
國內(nèi)比較好的培養(yǎng)基生產(chǎn)廠家推薦中海生物技術(shù)。中海生物技術(shù)培養(yǎng)基生產(chǎn)廠家的優(yōu)勢如下:生產(chǎn)能力強:具備充足的備貨能力,確保第一時間交付,滿...
-
212023-12
胰酪大豆胨液體培養(yǎng)基TSB供應商,價格,采購 - 中海生物技術(shù)
胰酪大豆胨液體培養(yǎng)基(以下簡稱TSB)是一種廣譜性培養(yǎng)基,用于細菌的培養(yǎng)和藥品及生物制品的無菌實驗及藥品微生物限度檢查中供試品的稀釋或...
-
182023-12
胰酪大豆胨瓊脂(TSA)供應商,價格,采購 - 中海生物技術(shù)
中海生物技術(shù)提供胰酪大豆胨瓊脂(TSA)的供應、價格、采購等服務。TSA胰酪大豆胨瓊脂培養(yǎng)基是常用的培養(yǎng)基之一,歡迎咨詢。
-
182023-12
中海生物技術(shù)怎么樣?公司官網(wǎng)和電話是多少?
中海生物技術(shù)是一家專業(yè)從事獸用生物制品研究開發(fā)、成果轉(zhuǎn)化、生產(chǎn)、銷售為一體的高新技術(shù)企業(yè)。
-
072023-12
微生物培養(yǎng)基從哪買
在尋找微生物培養(yǎng)基的購買渠道時,您可以通過多種途徑進行選擇。以下是一些購買培養(yǎng)基的推薦渠道:官方網(wǎng)站:首先,您可以搜索相關(guān)的生產(chǎn)公司的...
-
282023-11
山東哪個培養(yǎng)基,國內(nèi)的培養(yǎng)基哪家好!
山東哪個培養(yǎng)基,國內(nèi)的培養(yǎng)基哪家好,答:棗莊中海生物技術(shù)作為國內(nèi)培養(yǎng)基行業(yè)的佼佼者,棗莊中海生物技術(shù)在產(chǎn)品研發(fā)方面具有豐富的經(jīng)驗和領(lǐng)先...
-
282023-11
中海生物是做什么的
中海生物技術(shù)計劃建立行業(yè)先進的培養(yǎng)基凈化車間及5條生產(chǎn)線,以及滿足最新版GMP要求的診斷試劑生產(chǎn)線2條。這些生產(chǎn)線將采用先進的生產(chǎn)設備...
-
272023-09
中海生物技術(shù)2023年中秋節(jié)、國慶節(jié)放假安排通知
中海生物技術(shù)全體員工:根據(jù)國務院辦公廳通知精神,現(xiàn)將2023年中秋節(jié)、國慶節(jié)放假安排通知如下:2023年9月29日(星期五)至10月6...
-
182023-06
中海生物技術(shù)2023年端午節(jié)放假安排通知
中海生物技術(shù)2023年端午節(jié)放假安排通知:2023年6月22日(星期四)至6月24日(星期六)放假調(diào)休,共3天。6月25日(星期日)上班。
-
262023-04
中海生物棗莊公司兔年2023年勞動節(jié)放假安排通知
中海生物技術(shù)(棗莊)有限公司2023年勞動節(jié)放假安排通知,2023年4月29日(星期六)至5月3日(星期三)放假調(diào)休,共5天。4月23...
-
032023-04
中海生物技術(shù)2023年清明節(jié)放假安排通知
中海生物技術(shù)(棗莊)有限公司2023年清明節(jié)放假安排通知,經(jīng)公司領(lǐng)導同意,2023年4月5日(星期三)放假,共1天。
-
102023-01
2023癸卯年中海生物公司春節(jié)放假通知安排
中海生物公司現(xiàn)將2023年春節(jié)放假安排、相關(guān)要求通知如下:2023年1月21日-2023年1月27日放假,共7天,1月28日(星期六)...
-
282022-12
中海生物公司兔年2023年元旦放假安排通知
中海生物技術(shù)公司元旦放假時間為2022年12月31日至2023年1月2日放假,共計3天;2023年1月3日正常上班。
-
202022-12
熱烈祝賀中海生物《獸藥GMP》動態(tài)驗收順利通過!
熱烈祝賀中海生物技術(shù)(棗莊)有限公司新版獸藥GMP動態(tài)驗收順利通過,成為了棗莊市首家通過新版獸藥GMP的企業(yè)。